...
--> Một số tóm tắt về dòng SG 9R
--> Sự nhiễm bệnh và cơ chế tạo sự bảo hộ của cơ thể khi đối mặt với Salmonella
--> Sử dụng vắc-xin Salmonella Gallinarum 9R trong đàn gà
...
VẮC-XIN SALMONELLA GALLINARUM 9R
(Salmonella Gallinarum 9R strain as vaccine)
Tác giả: Edir N. Silva – Campinas, SP. – Brazil
.
MỘT SỐ TÓM TẮT VỀ DÒNG SG 9R
Dòng R (viết tắt của Rough: bề mặt xù xì) của vi khuẩn Salmonella Gallinarum (SG) được đặt tên là 9R vì dòng này được phát hiện ở Anh từ môi trường nuôi cấy thứ 9 của dòng có độc lực. Dòng 9R này do Smith giới thiệu lần đầu tiên vào năm 1956, dựa vào phương pháp làm mất độc lực của vi khuẩn bằng cách tạo đột biến qua bề mặt xù xì. Một số nhà sản xuất đã chứng minh độ an toàn của vi khuẩn này trong vắc-xin, với đặc điểm không phục hồi lại độc lực, và có khả năng bảo vệ gà chống lại bệnh Thương hàn (Fowl Typhoid). Vì thế, dòng 9R được sử dụng rộng rãi trong một số nước đang bị dịch bệnh này hoành hành. Bệnh Thương hàn Gà chủ yếu xuất hiện trên gà mái nâu, nhưng cũng có thể gây bệnh trên gà mái lông trắng và gà giống.
Một trong những lợi ích lớn nhất của việc sử dụng vắc-xin SG 9R là sự bảo hộ tốt và không gây cản trở cho các xét nghiệm phát hiện bệnh bạch lị do Salmonella pullorum. Bên cạnh việc kiểm soát bệnh Thương hàn Gà, vắc-xin SG 9R cũng được dùng trong một số nước như một công cụ phụ trợ trong việc kiểm soát Salmonella Enteritidis (SE) trong đàn gà mái thương phẩm. Miễn dịch tốt hơn, chi phí thấp hơn khi so sánh với các vắc-xin bất hoạt, không gây ra các phản ứng cục bộ, chính là ưu điểm vượt trội của vắc-xin SG 9R.
.
SỰ NHIỄM BỆNH VÀ CƠ CHẾ TẠO SỰ BẢO HỘ CỦA CƠ THỂ KHI ĐỐI MẶT VỚI SALMONELLA
Bệnh Thương hàn trên gà và gà tây do Salmonella enterica, serovar Gallinarum (viết tắt là S. Gallinarum) gây ra. Thể cấp tính thường xảy ra hiện tượng nhiễm trùng máu, xuất hiện ở giai đoạn phát triển của gà và trong các đàn gà lớn; mặc dù, độ tuổi không phải là yếu tố ảnh hưởng đến sự phân bố của bệnh (Berchieri, và cộng sự, 2001). Biểu hiện bệnh nặng hay nhẹ tùy thuộc nhiều vào bộ gien của đàn gà đang nuôi. Gà giống màu hướng trứng rất nhạy cảm, trong khi gà trắng giống Leghorn có khả năng đề kháng cao hơn, mặc dù vi khuẩn vẫn tồn tại trong cơ thể chúng trong một thời gian khá dài (Berchieri Jr., và cộng sự, 2000).
Dòng đột biến R của S. Gallinarum (SG), có tên 9R, được phát hiện ở Anh từ môi trường nuôi cấy thứ 9 của dòng có độc lực (Smith, 1956), và được sử dụng để sản xuất vắc-xin rộng rãi trên thế giới.
Khi dòng 9R xâm nhập vào cơ thể, nó chỉ gây nhiễm bệnh nhẹ, bệnh không kéo dài và kích thích cả miễn dịch dịch thể và miễn dịch tế bào với khả năng đáp ứng miễn dịch đạt mức cao trong thời gian ngắn ngay sau khi vi khuẩn bị phân giải. Sau khi tiêm phòng ba tuần, vi khuẩn sẽ bị phân giải, và đây cũng chính là thời điểm gia tăng kháng thể chống lại Salmonella, tăng nhanh số lượng tế bào T và xuất hiện ngày càng nhiều các interferon gamma. Vắc-xin này sẽ không tồn tại lâu trong hệ thống dạ dày - ruột (Silva, và cộng sự, 1981; Wigley, và cộng sự, 2005).
Rất khó phân biệt sự đáp ứng miễn dịch chống lại SG khi gia cầm bị nhiễm ngoài tự nhiên hay do được chủng ngừa với vắc-xin sống (Jones, và cộng sự, 2001), thế nhưng, sự đáp ứng miễn dịch này đã được chứng minh có liên quan đến các protein lớp màng ngoài (Outer Membrane Proteins: OMP).
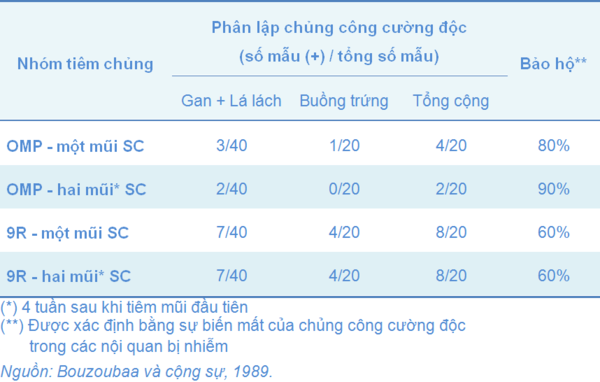
Việc tiêm chủng dưới da với OMP tinh lọc từ dòng SG, cho kết quả bảo hộ khả quan hơn ở các gà thí nghiệm khi công cường độc bằng chủng SG ngoài môi trường (so sánh với vắc-xin 9R tiêm dưới da) như Bảng 1. Hiệu lực bảo hộ được xác định bằng sự biến mất của chủng công cường độc trong các nội quan của cơ thể gà thí nghiệm (Bouzoubaa, và cộng sự, 1989).
Bảng 1 Thí nghiệm so sánh sự bảo hộ trước bệnh Thương hàn Gà khi chủng ngừa dưới da (Subcutaneous: SC) với protein lớp màng ngoài (OMP) của Salmonella Gallinarum và chủng 9R
.
SỬ DỤNG VẮC-XIN SALMONELLA GALLINARUM 9R TRONG ĐÀN GÀ
Vắc-xin SG 9R
Vắc-xin SG 9R là huyễn dịch của chủng SG sống, không gây bệnh, dòng R (có bề mặt xù xì). Đây là chủng thường được sử dụng để làm vắc-xin chống lại bệnh Thương hàn Gà (Harbourne và cộng sự, 1963) và ở dạng đông khô.
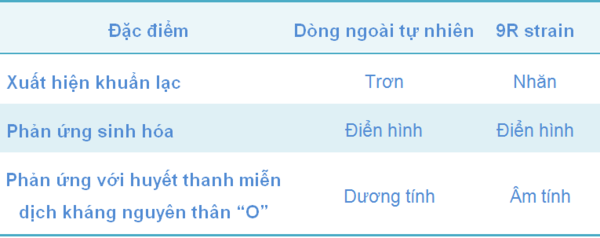
Dòng 9R không chứa đặc điểm kháng nguyên thân O (the somatic antigen) như dòng SG độc lực (có bề mặt trơn), nhưng cả hai dòng này đều cho các phản ứng sinh hóa giống nhau. Tuy nhiên, huyễn dịch của dòng 9R, cả phần nước hay môi trường thạch, khi thử nghiệm nhanh trên phiến kính với acriflavine (một chất có nguồn gốc từ acridine và được dùng làm chất khử trùng) đều bị ngưng kết.
Bảng 2 Đặc điểm các dòng Salmonella Gallinarum
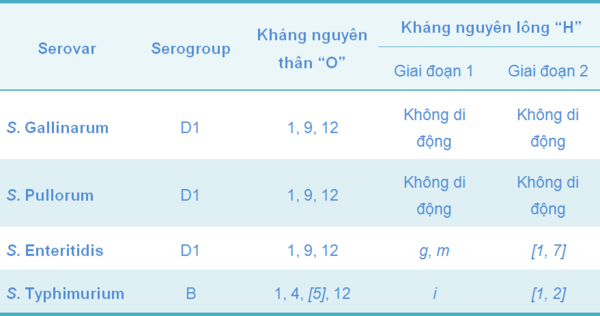
SG là serovar không di động (chúng không có lông roi để di chuyển), thuộc nhóm Salmonella serogroup D1, với kháng nguyên thân 1, 9 và 12, cùng nhóm với các chủng gây bệnh khác cho gà như S. Enteritidis (SE) and S. Pullorum (SP). Vì thế, giữa các chủng này có sự bảo hộ chéo (Bảng 3). Vắc-xin dòng SG 9R đã được sử dụng ở vài nước như một công cụ hỗ trợ để kiểm soát SE ở các đàn gà mái đẻ thương phẩm (Feberwee và cộng sự, 2001).
Bảng 3 Phân loại các chủng Salmonella gây bệnh quan trọng nhất ở gia cầm
.
Sử dụng vắc-xin SG 9R trong đàn Gà
Vắc-xin SG 9R phòng bệnh Thương hàn Gà nên được sử dụng trước khi đàn tiếp xúc với mầm bệnh thật sự ngoài môi trường, và nên tìm hiểu các chủng hiện đang gây bệnh Thương hàn trong khu vực. Do khả năng bảo hộ chéo nên vắc-xin này cũng được sử dụng như công cụ để kiểm soát sự nhiễm SE trong đàn gà mái đẻ và đàn gà giống.
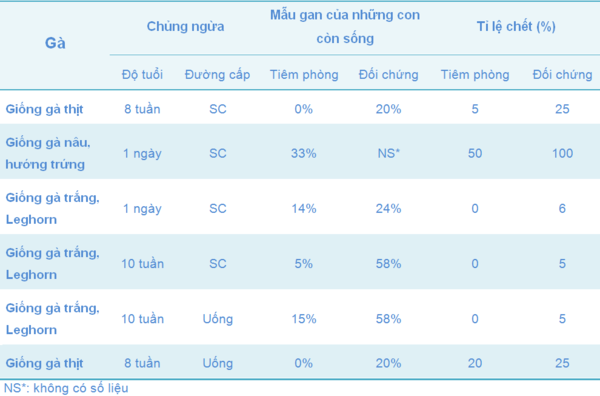
Tiêm phòng sẽ giúp đàn giảm các tổn thất do Thương hàn Gà gây ra, góp phần làm giảm sự nhiễm SE và sự lây truyền mầm bệnh qua trứng trong đàn bị nhiễm, tuy nhiên, triệu chứng bệnh vẫn có thể xảy ra ở các gà đã tiêm phòng (Bảng 4 và 5).
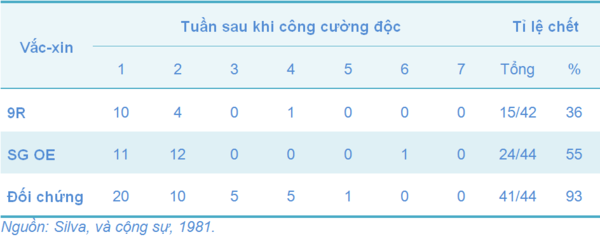
Bảng 4 Tỉ lệ bệnh và tỉ lệ chết của gà đã được chủng ngừa với 9R sau khi công cường độc bốn tuần với chủng gây bệnh S. Gallinarum
Bảng 5 Tỉ lệ chết sau khi công cường độc các gà một ngày tuổi được tiêm phòng với vắc-xin chủng 9R và vắc-xin nhũ tương dầu (oil-emulsion: OE) bằng đường tiêm dưới da
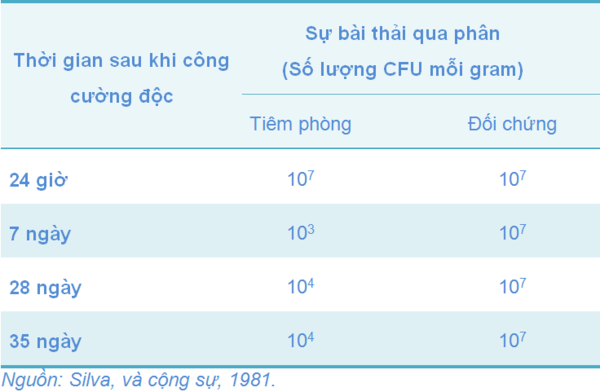
Có một số nghiên cứu cho thấy khi sử dụng vắc-xin 9R có thể làm giảm sự bài thải các serogroup không cùng nhóm như S. Typhimurium (Bảng 6).
Bảng 6 Sự bảo hộ của gà trắng giống Leghorn 10 tuần tuổi được tiêm phòng với vắc-xin 9R (107 CFU/liều) và sau đó sáu tuần bị công cường độc với Salmonella Typhimurium (109 CFU/con) qua đường uống
Tiêm phòng nên được xem như một phần kế hoạch loại trừ hoàn toàn bệnh Thương hàn Gà và SE.
.
Tiêm phòng: Liều lượng, Độ tuổi và Đường cấp
Nồng độ chuẩn của vắc-xin là quan trọng nhất. Mỗi liều nằm trong khoảng từ 106 đến 107 đơn vị khuẩn lạc (colony forming units – CFU) (theo OIE, 2004).
Tiêm dưới da (SC) hay tiêm bắp (IM) đều là những đường cấp thuốc thông dụng nhất trong chủng ngừa. Khi thực hiện tiêm phòng, sử dụng hai mũi vắc-xin sẽ bảo vệ tốt hơn chỉ dùng một mũi. Vắc-xin pha với nước uống cũng được dùng trong một số trường hợp, nhưng khả năng bảo hộ sẽ thấp hơn. Xem Bảng 4 (Bouzoubaa, và cộng sự, 1989; Silva, và cộng sự, 1981).
Tiêm phòng thường được thực hiện tại thời điểm 6 - 8 tuần tuổi và tiêm nhắc lại ở 14 - 16 tuần tuổi. Dữ liệu trong các thí nghiệm cho thấy gà con hướng thịt được tiêm phòng vào một ngày tuổi ở các trại ấp không gây trở ngại gì cho các thông số phát triển của chúng.
Nên tái chủng và khi thực hiện phải tránh giai đoạn đẻ trứng; và vào thời điểm trước và sau khi tiêm phòng, không được sử dụng kháng sinh.
Dựa theo ảnh hưởng của sự tăng trọng lượng cơ thể, 4 tuần tuổi là thời điểm sớm nhất được thực hiện chủng ngừa với vắc-xin 9R này để bảo đảm an toàn khi sử dụng và độ hiệu lực của vắc-xin (Lee và cộng sự, 2005).
.
Sự lây truyền của dòng SG 9R
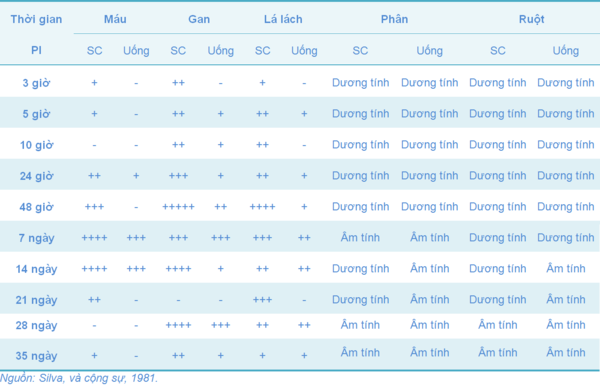
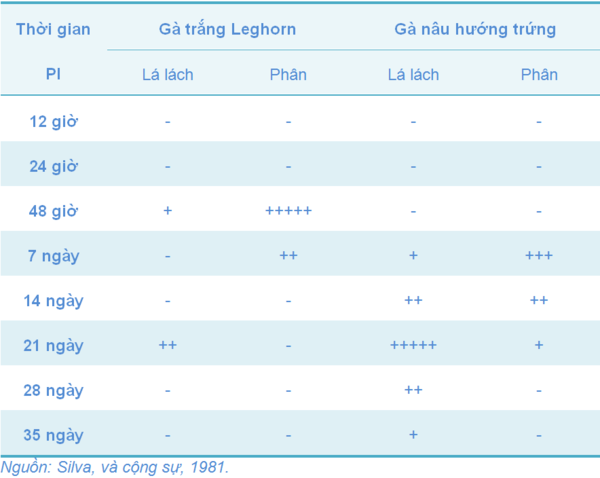
Dòng 9R trong vắc-xin có thể tồn tại thời gian dài hay ngắn trong cơ thể sau khi tiêm phòng là tùy thuộc vào giống và độ tuổi của gà. Ví dụ như hai thí nghiệm ở Bảng 7 và 8 khi khảo sát sự nhiễm SG và sự chủng ngừa (Berchieri, và cộng sự, 2005; Silva, và cộng sự, 1981).
Bảng 7 Sự tồn tại của dòng 9R trong cơ thể gà hướng thịt, được tiêm phòng vào thời điểm một ngày tuổi bằng đường tiêm dưới da (SC) và đường uống
Bảng 8 Sự tồn tại của dòng 9R trong cơ thể gà ở hai giống khác nhau, được tiêm phòng vào thời điểm một ngày tuổi bằng đường tiêm dưới da (SC)
Chủng 9R có thể lây truyền qua trứng trong một vài trường hợp nếu việc tiêm phòng được thực hiện trong giai đoan gà đang đẻ trứng, nhưng hiện tượng này rất khó xảy ra. Chủng 9R chỉ phát hiện trong một vài trường hợp sau một tuần chủng ngừa, ở mức tỉ lệ nhiễm 1% với độ tin cậy 95% (Feberwee, và cộng sự, 2001). Trong một nghiên cứu khác, chủng vắc-xin không thể tìm thấy trong bất kì 450 mẫu gộp thu thập (10 mẫu trứng được trộn vào một mẫu), chứng tỏ rằng việc phân tán mầm bệnh qua trứng rất hiếm khi xảy ra (Feberwee, và cộng sự, 2001a). Ngay cả thử nghiệm gây nhiễm bệnh Thương Hàn trên đàn gà thí nghiệm, sự lây truyền qua trứng cũng hiếm khi xảy ra (Berchieri, và cộng sự, 2005).
Lây truyền ngang của dòng SG 9R cũng không xuất hiện. Trong các thí nghiệm nghiên cứu ở bốn trại nuôi thương phẩm khác nhau và ở một trại gà hướng trứng, khả năng lây truyền của chủng vắc-xin từ các đàn chủng ngừa sang các đàn chưa chủng ngừa không xảy ra ở cả giai đoạn sau mũi tiêm thứ nhất hay tái chủng. Các đàn chủng ngừa và không chủng ngừa được theo dõi và lấy mẫu thường xuyên để kiểm tra vi sinh và huyết thanh học. Không xảy ra hiện tượng lây nhiễm qua phân của chủng vắc-xin (Feberwee, và cộng sự, 2001). Theo thí nghiệm, gà hướng thịt có thể bài thải dòng 9R qua phân trong vòng năm tuần sau khi chủng ngừa khi tiến hành tiêm phòng vào một ngày tuổi; sự bài thải này sẽ giảm xuống còn trong vòng 24 giờ sau khi tiêm phòng khi gà được chủng ngừa vào thời điểm 8 tuần tuổi, nhưng đối với giống gà trắng Leghorns sẽ không phát hiện chủng 9R khi tiêm phòng vào lúc 10 tuần tuổi, và đối với gà hướng thịt phải thực hiện chủng ngừa vào lúc một năm tuổi bằng đường tiêm dưới da (Silva, và cộng sự, 1981).
.
Tiêm phòng với SG 9R ở gà hướng trứng
Một số phương pháp đơn giản có thể thực hiện ở đàn gà bị nhiễm bệnh Thương hàn nhằm hạn chế căn bệnh. Ví dụ như, loại thải nhanh chóng những con gà chết khỏi trại để tránh lây nhiễm và làm giảm tỉ lệ bị nhiễm bệnh trong đàn (Oliveira, và cộng sự, 2005).
Bên cạnh việc kiểm soát bệnh Thương hàn, vắc-xin SG 9R cũng thường được sử dụng như công cụ hỗ trợ trong việc kiểm soát và làm giảm sự nhiễm bệnh SE trong đàn gá mái thương phẩm, nhưng không có nghĩa đây là công cụ thay thế hoàn toàn trong việc bảo vệ đàn gà chống lại sự lây nhiễm ngoài tự nhiên (Feberwee, và cộng sự, 2001).
Trong một thí nghiệm ở Hà Lan, 80 đàn gà mái thương phẩm trong một vùng có nguy cơ nhiễm SE cao đã được chủng ngừa với vắc-xin SG 9R. Thí nghiệm thực hiện bằng cách đánh giá sự xuất hiện của SE gây bệnh trong nhóm được tiêm phòng so với nhóm không được tiêm phòng gồm 1.854 đàn có độ tuổi tương tự nhau. Sự nhiễm bệnh SE trong nhóm được chủng ngừa là 2/80 (2,5%) với độ tin cậy 99% (P =0,01), thấp hơn nhóm không được chủng ngừa (214/1.854 = 11,5%). Bảng 9 (Feberwee, và cộng sự, 2001a).
Bảng 9 Thí nghiệm đánh giá sự xuất hiện của SE gây bệnh trong đàn gà mái thương phẩm
.
Phản ứng huyết thanh học đối với sự chủng ngừa vắc-xin SG 9R
Mặc dù 9R là chủng có bề mặt xù xì, không di động và không có kháng nguyên thân “O”, nhưng nó vẫn kích thích sản sinh kháng thể (Ab) tạm thời với thời gian đáp ứng phụ thuộc vào phương pháp xét nghiệm sử dụng. Không có mối quan hệ trực tiếp giữa mức Ab hiện diện và sự bảo hộ của cơ thể, mặc dù Ab đặc hiệu có thể có một số ảnh hưởng nào đó (Bouzoubaa, và cộng sự, 1989; Silva, và cộng sự, 1981). Các thử nghiệm phản ứng huyết thanh học có thể phát hiện kháng nguyên (Ag) tấn công OMP (các protein ở lớp màng ngoài) nhưng không tìm thấy kháng nguyên thân, trong khi tất cả gà được tiêm phòng với chủng 9R hay với OMP đều tìm thấy kháng thể qua thử nghiệm phản ứng vi ngưng kết (microagglutination: MAG), và trong một số nhóm được tiêm chủng có thể thấy 100% gà tiêm phòng có kháng thể khi thử nghiệm phản ứng ngưng kết huyết thanh (Bouzoubaa, và cộng sự, 1989).
Phản ứng MAG có độ nhạy cảm cao hơn phản ứng pullorum (để phát hiện Salmonella Pullorum) trong việc phát hiện kháng thể. Do đó, phản ứng MAG có thể dùng để phát hiện kháng thể ở giai đoạn sớm, khoảng hai tuần sau khi chủng ngừa (post-vaccination: PV), với 100% gà tìm thấy kháng thể vào thời điểm 7 tuần tuổi sau khi chửng ngừa mũi đầu tiên bằng đường tiêm dưới da (SC). Một số nơi thực hiện phản ứng pullorum có thể phát hiện được kháng thể trong khoảng 2 đến 7 tuần sau khi chủng ngừa. Các kết quả phản ứng huyết thanh này đưa ra vài gợi ý về thời điểm ít nhất bảy tuần nên được thực hiện giữa việc tiêm phòng với 9R và kiểm nghiệm phản ứng bệnh bạch lị (Silva, và cộng sự, 1981).
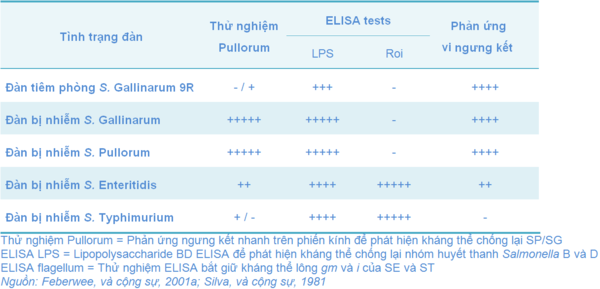
Ngoài ra, các đàn đã tiêm phòng với SG 9R có thể thực hiện các phản ứng phân biệt với các đàn bị nhiễm SG, SP, SE hay S. Typhimurium (ST) như được trình bày ở bảng 10.
Có một số trại nuôi gà thương phẩm thực hiện phản ứng Elisa để phát hiện kháng thể chống lại Salmonella. Bộ kít thử nghiệm gián tiếp LBS-BD-Elisa (ID-Lelystad, công ty Lelystad, Hà Lan) phát hiện kháng thể chống Salmonella thuộc nhóm kháng nguyên B và D (có kháng nguyên thân 1, 4, 5, 9 và 12). Các bộ kít thử nghiệm chuyên biệt khác có sẵn gm và i-DAS-Elisa có tính chuyên biệt và độ nhạy cao hơn để phát hiện kháng thể chống lại gm và kháng nguyên lông I của SE và ST.
Đàn gà mái được tiêm phòng với SG 9R cho kết quả 0% dương tính với thử nghiệm pullorum (phản ứng ngưng kết nhanh trên phiến kính để phát hiện kháng thể chống lại SP/SG). Khi sử dụng thí nghiệm LPS-BD-Elisa, đàn gà này cho phản ứng dương tính là 59.0%. Và công cụ chuyên biệt của hai thành phần bắt giữ trong thử nghiệm ELISA (gm- và đôi kháng thể i- của ELISA) trong cùng loại huyết tương tương ứng là 99.6% và 96.1% (Feberwee, và cộng sự, 2001a).
Bảng 10 Phản ứng huyết thanh học của gà được chủng ngừa với SG 9R và gà bị nhiễm bệnh với chủng Salmonella thường gây bệnh nhiều nhất ở gia cầm
.
Làm thế nào để biết được khả năng bảo hộ của vắc-xin trong cơ thể gà?
Không có phương pháp nào có thể ước lượng chính xác khả năng bảo hộ do vắc-xin đem lại khi thực hiện tiêm phòng trong trại. Tuy nhiên, kinh nghiệm được đưa ra là vắc-xin có thể cung cấp một số thuận lợi trong trường hợp các trại không thể kiểm soát chỉ bằng phương pháp vệ sinh và quản lý trại.
Trong phòng thí nghiệm, đánh giá khả năng bảo hộ dựa vào tỉ lệ chết và tái phân lập dòng công cường độc (tốc độ biến mất). Sự tiêm phòng ở gà mái tơ ở thời điểm 2, 4 và 6 tuần tuổi sẽ cung cấp khả năng bảo hộ chống lại dòng SG gây bệnh, quan sát được ở ngày thứ 21 sau khi tiêm mũi đầu tiên, và khi xem xét tỉ lệ chết, sẽ cho kết quả từ 0% đến 5% trong nhóm được tiêm phòng, trong khi trong nhóm đối chứng, không được tiêm phòng là 95% đến 100%. Thêm vào đó, trong nhóm đối chứng sẽ thấy 95% đến 100% trường hợp phân lập được dòng công cường độc trong các mẫu lấy ở nội quan bên trong và manh tràng, trong khi nhóm được tiêm phòng thì tỉ lệ này là 1% đến 60% trong các mẫu quan sát được. Bảng 11 (Lee, và cộng sự, 2005).
Bảng 11 Thử nghiệm trong phòng thí nghiệm để đánh giá sự bảo hộ của vắc-xin 9R vào thời điểm 2, 4 và 6 tuần tuổi trong đàn gà đẻ được tiêm phòng với liều đầu tiên
.
An toàn và phản ứng sau khi tiêm của dòng SG-9R
Dòng 9R không phải là dòng gây bệnh cho người, và không có mối nguy hiểm đặc biệt có liên quan đến cách chế tạo hay sử dụng vắc-xin.
Dòng SG 9R đã được chứng minh sự an toàn cho gà mà không thấy hiện tượng hồi phục độc lực gây bệnh và không phân tán trong đàn không phải là chủ thể đích, mặc dù dòng đột biến có thể đề kháng với khánh sinh và trong vài trường hợp có thể tạo điều kiện xuất hiện truyền nhiễm hệ thống trong cơ thể (Silva và cộng sự, 1981).
Bệnh tích nhẹ có thể nhìn thấy ở gan và lá lách của gà con giống nâu hướng trứng và gà con hướng thịt được tiêm phòng vào một ngày tuổi, nhưng không thấy ở giống gà trắng leghorn được tiêm phòng với điều kiện như nhau (Silva và cộng sự, 1981).
Vì vắc-xin gây ra sự truyền nhiễm hệ thống trong thời gian ngắn với sự nhân lên ở gan và lá lách trong suốt tuần đầu tiên sau khi tiêm phòng, một vài giai đoạn phát triển có thể giảm xuống một chút, nhưng không gây chết, mặc dù đây không phải là yếu tố quan sát chính (Silva và cộng sự, 1981).
Tiêm phòng ở gà hướng trứng 2 tuần tuổi với một hay 10 mũi có thể gây ra sự sụt giảm nhỏ trong trọng lượng tăng trưởng cơ thể vào 5 tuần đầu, nhưng hiện nay, gà được tiêm phòng dù với một hay 10 mũi vào 4 và 6 tuần tuổi sẽ không thấy hiện tượng này - Bảng 12 (Lee, và cộng sự, 2005), hay trên giống gà trắng leghorn (Silva và cộng sự, 1981).
Bảng 12 Ảnh hưởng của một hay 10 mũi tiêm vắc-xin 9R trên trọng lượng tăng trưởng cơ thể của gà hướng trứng
.
TÀI LIỆU THAM KHẢO
Berchieri Jr., A., Oliveira, GH., Pinheiro, LAS., & Barrow, P. 2000. Experimental Salmonella gallinarum infection in light laying hen lines. Braz. J. Microbiol. 31:50-52.
Bouzoubaa, K., Nagaraja, KV., Kabbaj, FZ., Newman, JA., Pomeroy, BS. 1989. Feasibility of using proteins from Salmonella gallinarum vs. 9R live vaccine for the prevention of fowl typhoid in chickens. Avian Dis. 33:385-391.
Feberwee, A., de Vries, TS., Hartman, EG., de Wi,t JJ., Elbers, AR., de Jong, WA. 2001a. Vaccination against Salmonella enteritidis in Dutch commercial layer flocks with a vaccine based on a live Salmonella gallinarum 9R strain: evaluation of efficacy, safety, and performance of serologic Salmonella tests. Avian Dis., 45:83-91.
Feberwee, A., Hartman, EG., de Wit, JJ., de Vries, TS. 2001. The spread of Salmonella gallinarum 9R vaccine strain under field conditions. Avian Dis., 45:1024-1029.
Harbourne, JF., Williams, BM., Parker, WH. & Fincham, IH., 1963. The prevention of fowl typhoid in the field using a freeze-dried 9R vaccine. Vet. Rec., 75:858-861.
Jones, MA., Wigley, P., Page, KL., Hulme, SD., Barrow, PA. 2001. Salmonella enterica Serovar Gallinarum requires th Salmonella pathogenicity island 2 type III secretion system but not the Salmonella pathogenicity island 1 type III secretion system for virulence in chickens. Infect. and Immun., 69:5471-5476.
Lee, YJ., Mo, IP., & Kang, MS. 2005. Safety and efficacy of Salmonella gallinarum 9R vaccine in young laying chickens. Avian Pathol 34:362-366.
OIE. 2004. Fowl typhoid and pullorum disease. OIE terrestrial Manual. Chap. 2.7.5. p.868-877.
Oliveira, GH., Berchieri Jr., A., Fernandes, AC. 2005. Experimental infection of laying hens with Salmonella enterica serovar Gallinarum.Braz. J. Microbiol. 36:51-56.
Ryll, M., & Hinz, KH. 1995. [Differentiation of Salmonella gallinarum rough and smooth strains using gas chromatography analysis of their cell-bound fatty acids] [Article in German]. Berl Munch Tierarztl Wochenschr. 108:347-349.
Silva, EN., Snoeyenbos, GH., Weinack, OM., Smyser CF. 1981. Studies on the use of 9R strain of Salmonella gallinarum as a vaccine in chickens. Avian Dis. 25:38-52.
Smith, HW. 1956. The use of live vaccine in experimental Salmonella gallinarum infection in chickens with observations on their interference effect. J. Hyg. 54:419-432.
Wigley, P., Hulme, S., Powers, C., Beal, R., Smith, A., Barrow, P. 2005. Oral infection with the Salmonella enterica serovar Gallinarum 9R attenuated live vaccine as a model to characterize immunity to fowl typhoid in the chicken. Vet. Res., 2:1-9.

 Corporate Website
Corporate Website
 Africa
Africa
 Argentina
Argentina
 Asia
Asia
 Australia
Australia
 Belgium
Belgium
 Brazil
Brazil
 Bulgaria
Bulgaria
 Canada (EN)
Canada (EN)
 Chile
Chile
 China
China
 Colombia
Colombia
 Denmark
Denmark
 Egypt
Egypt
 France
France
 Germany
Germany
 Greece
Greece
 Hungary
Hungary
 Indonesia
Indonesia
 Italia
Italia
 India
India
 Japan
Japan
 Korea
Korea
 Malaysia
Malaysia
 Mexico
Mexico
 Middle East
Middle East
 Netherlands
Netherlands
 Peru
Peru
 Philippines
Philippines
 Poland
Poland
 Portugal
Portugal
 Romania
Romania
 Russia
Russia
 South Africa
South Africa
 Spain
Spain
 Sweden
Sweden
 Thailand
Thailand
 Tunisia
Tunisia
 Turkey
Turkey
 Ukraine
Ukraine
 United Kingdom
United Kingdom
 USA
USA
 Vietnam
Vietnam